苏州大学放射医学与辐射防护国家重点实验室、放射医学与防护学院分子影像与核医学研究中心发现超小Cu2−xSe纳米颗粒(简写为CS NPs)调控肿瘤相关巨噬细胞表型增强抗肿瘤免疫的新机制。相关成果以“Reprogramming Tumor-Associated Macrophages via ROS-Mediated Novel Mechanism of Ultra-Small Cu2−xSe Nanoparticles to Enhance Anti-Tumor Immunity”为题发表在Adv. Funct. Mater.杂志上(Adv. Funct. Mater. DOI: 10.1002/adfm.202108971)。论文链接:https://doi.org/10.1002/adfm.202108971。
调节抑制性肿瘤免疫微环境(TIME)重建免疫监测系统是非常有前景的肿瘤免疫疗法。实体瘤中存在较为丰富的肿瘤相关巨噬细胞(TAMs),通常表现为促进肿瘤生长的M2型巨噬细胞,对肿瘤生长、转移、侵袭发挥着重要作用。此外,它们还通过降低T细胞的活性抑制适应性免疫。相反地,M1型巨噬细胞具有较强的肿瘤杀伤和抗原提呈能力,可通过激活抗肿瘤T细胞反应而增强抗肿瘤效果。因此,将TAMs从免疫抑制性的M2表型极化为抑制肿瘤生长的M1表型是抗肿瘤免疫治疗的重要策略。然而,利用无机纳米颗粒的固有性质调控TAMs表型鲜有报道,其调控作用机制尚不明确。
在前期工作之中,分子影像与核医学研究中心团队构建了“富含空位”的超小纳米颗粒。“空位”使得纳米颗粒产生新颖的性质,如它们在近红外一区及二区(NIR I及NIR II)具有较强的吸收,可以将近红外光高效地转化为热,用于肿瘤的光声成像和光热治疗(Adv. Mater. 2016, 28, 8927–8936;Adv. Mater. 2016, 28, 5072–5079;)。此外,空位还为调控纳米颗粒的功能提供了广阔空间(ACS Nano, 2017, 11, 5633-5645; ACS Nano, 2019, 13,1342-1353; ACS Appl. Mater. Interfaces 2020, 12, 4231−4240; Nanoscale, 2018, 10, 3130-3143)。更重要的是,“富含空位”的超小Cu2-xSe纳米颗粒具有优异的生物可降解性和良好的生物相容性(Nano Lett, 2018, 18, 4985-4992),是构建多模态诊疗一体化纳米颗粒的理想选择。在近红外光照下,Cu2-xSe纳米颗粒通过电子转移和能量转移两种机制产生活性氧(ROS),实现光动力治疗肿瘤(Nanoscale, 2019, 11, 7600–7608; ACS Appl. Mater. Interfaces 2019, 11, 16367−16379)。在无光照的情况下,超小Cu2-xSe纳米颗粒可降解释放出Cu+离子(Nanoscale, 2019, 11, 11819-11829),与肿瘤内的H2O2通过类芬顿反应产生O2及ROS,实现化学动力治疗肿瘤(Adv. Funct. Mater. 2020, 30, 1906128)。
产生的ROS除了杀伤肿瘤细胞外,能否促进肿瘤相关巨噬细胞极化,调控其表型呢?在上述基础之上,研究团队发现超小Cu2-xSe纳米颗粒可有效地诱导巨噬细胞产生ROS,促进肿瘤坏死因子受体相关因子6(TRAF6)发生泛素化以激活干扰素调节因子5(IRF5),进一步增强其下游信号因子白细胞介素23(IL-23)的表达,从而显著降低M2型巨噬细胞标志物CD206和Arginase1(Arg1)的表达,增强M1型巨噬细胞标志物CD80和CD86的表达,有效地促进M2型巨噬细胞极化为M1型。这种ROS介导的巨噬细胞极化机制(ROS-TRAF6-IRF5-IL-23)明显不同于传统的ROS-NF-κB-iNOS机制。更重要的是,超小Cu2-xSe纳米颗成功地将黑色素瘤内的M2型TAMs极化为M1型,并增强了特异性的抗肿瘤CD8+ T细胞和免疫记忆反应,最终有效地抑制了B16F10肿瘤的生长及复发。
除了极化肿瘤相关巨噬细胞之外,将超小Cu2-xSe纳米颗粒修饰槲皮素后还能有效抑制小胶质细胞的过度激活,将其极化为具有神经保护作用的M2表型,缓解脑部氧化应激和改善炎症环境,显著提高帕金森疾病小鼠的学习和认知功能(J. Am. Chem. Soc. 2020, 142, 21730−21742)。
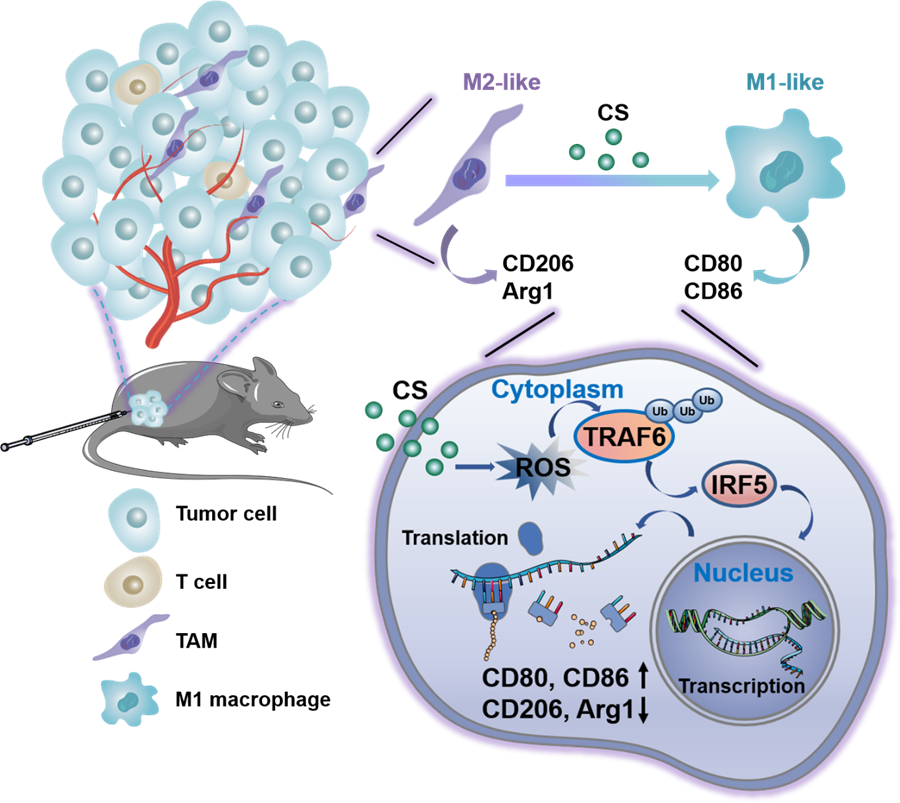
图1 Cu2-xSe纳米颗粒极化进肿瘤相关巨噬细胞增强抗肿瘤免疫的示意图
苏州大学放射医学与辐射防护国家重点实验室、放射医学与防护学院为论文第一单位,硕士研究生郑艳会为第一作者,李桢教授为通讯作者。该工作得到国家自然科学基金(81971671),国家纳米科技重点专项(2018YFA0208800),江苏省重点研发计划项目(BE2019660)等资助。